斐林試劑(Fehling's solution) ,還原糖的定量檢測
| 別名: | 費(fèi)林試劑 堿性酒石酸銅標(biāo)準(zhǔn)溶液 還原糖定量滴定檢測專用 | ||
|---|---|---|---|
| Cas號(hào): | 物化性質(zhì): | ||
| 分子式: | 熔點(diǎn): | ||
| 分子量: | 沸點(diǎn): | ||
| EINECS編號(hào): | 密度: | ||
| MDL號(hào): | 儲(chǔ)存條件: | ||

斐林試劑(Fehling's Reagent)又稱菲林試劑或裴林試劑,是德國化學(xué)家 Hermann von
Fehling 1849 年所發(fā)明。斐林試劑與班氏試劑(Benedict's Reagent)相似,均是用來檢測
還原糖的存在。其原理是與可溶性的還原性糖(葡萄糖、果糖和麥芽糖)在加熱的條件下,能
夠生成磚紅色的氧化亞銅沉淀。
【實(shí)驗(yàn)原理】還原糖是指含有自由醛基(如葡萄糖)或酮基(如果糖)的單糖和某些二糖(如乳糖和麥芽糖)。在堿性溶液中,還原糖能將Cu2+、Hg2+、Fe3+、Ag等金屬離子還原,而糖本身被氧化成糖酸及其他產(chǎn)物。糖類的這種性質(zhì)常被用于糖的定性和定量測定。
直接滴定法即費(fèi)林試劑熱滴定法。費(fèi)林試劑由甲溶液和乙溶液組成。甲溶液含硫酸銅和亞甲基藍(lán)(氧化還原指示劑);乙溶液含氫氧化鈉、酒石酸鉀鈉和亞鐵氰化鉀。將一定量的甲溶液和乙溶液等體積混合時(shí),硫酸銅與氫氧化鈉反應(yīng),生成氫氧化銅沉淀,在堿性溶液中,所生成的氫氧化銅沉淀與酒石酸鈉反應(yīng),生成可溶性的酒石酸鉀鈉銅絡(luò)合物。
在加熱條件下,用樣液滴定,樣液中的還原糖與酒石酸鉀鈉銅反應(yīng),酒石酸鉀鈉銅被還原糖還原,產(chǎn)生紅色氧化亞銅沉淀、反應(yīng)生成的氧化亞銅沉淀與費(fèi)林試劑中的亞鐵氰化鉀(黃血鹽)反應(yīng)生成可溶性復(fù)鹽,便于觀察滴定終點(diǎn)。
滴定時(shí)以亞甲基藍(lán)為氧化-還原指示劑。因?yàn)閬喖谆{(lán)氧化能力比二價(jià)銅弱,待二價(jià)銅離子全部被還原后,稍過量的還原糖可使藍(lán)色的氧化型亞甲基藍(lán)還原為無色的還原型的亞甲基藍(lán),即達(dá)滴定終點(diǎn)。根據(jù)樣液量可計(jì)算出還原糖含量。
本方法測定的是一大類具有還原性的糖,包括葡萄糖、果糖、乳糖、麥芽糖等,只是結(jié)果用葡萄糖或轉(zhuǎn)化糖表示而已。
本法又稱快速法,是目前最常用的測定還原糖的方法,也是國家標(biāo)準(zhǔn)分析方法。優(yōu)點(diǎn)是試劑用量少、操作簡單、快速、滴定終點(diǎn)明顯,適用于各類樣品中還原糖的測定。缺點(diǎn)是對(duì)深色樣品因色素干擾使終點(diǎn)難以判斷,從而影響其準(zhǔn)確性。
5 分析步驟
5.1 試樣制備
5.1.1 含淀粉的食品:稱取粉碎或混勻后的試樣10g~20g(精確至0.001g),置250mL容量瓶中,加
水200mL,在45℃水浴中加熱1h,并時(shí)時(shí)振搖,冷卻后加水至刻度,混勻,靜置,沉淀。吸取200.0mL
上清液置于另一250mL容量瓶中,緩慢加入乙酸鋅溶液 5mL和亞鐵氰化鉀溶液5mL,加水至刻度,混勻,靜置30min,用干燥濾紙過濾,棄去初濾液,取后續(xù)濾液備用。
5.1.2 酒精飲料:稱取混勻后的試樣100g(精確至0.01g),置于蒸發(fā)皿中,用氫氧化鈉溶液中和至中
性,在水浴上蒸發(fā)至原體積的1/4后,移入250mL容量瓶中,緩慢加入乙酸鋅溶液5mL和亞鐵氰化鉀溶液5mL,加水至刻度,混勻,靜置30min,用干燥濾紙過濾,棄去初濾液,取后續(xù)濾液備用。
5.1.3 碳酸飲料:稱取混勻后的試樣100g(精確至0.01g)于蒸發(fā)皿中,在水浴上微熱攪拌除去二氧化碳后,移入250mL容量瓶中,用水洗滌蒸發(fā)皿,洗液并入容量瓶,加水至刻度,混勻后備用。
5.1.4 其他食品:稱取粉碎后的固體試樣2.5g~5g(精確至0.001g)或混勻后的液體試樣5g~25g
(精確至0.001g),置250mL容量瓶中,加50mL水,緩慢加入乙酸鋅溶液5mL 和亞鐵氰化鉀溶液
5mL,加水至刻度,混勻,靜置30min,用干燥濾紙過濾,棄去初濾液,取后續(xù)濾液備用。
5.3 試樣溶液預(yù)測
吸取堿性酒石酸銅甲液5.0mL和堿性酒石酸銅乙液5.0mL于150mL錐形瓶中,加水10mL,加
入玻璃珠2粒~4粒,控制在2min內(nèi)加熱至沸,保持沸騰以先快后慢的速度,從滴定管中滴加試樣溶
液,并保持沸騰狀態(tài),待溶液顏色變淺時(shí),以1滴/2s的速度滴定,直至溶液藍(lán)色剛好褪去為終點(diǎn),記錄樣品溶液消耗體積。
注:當(dāng)樣液中還原糖濃度過高時(shí),應(yīng)適當(dāng)稀釋后再進(jìn)行正式測定,使每次滴定消耗樣液的體積控制在與標(biāo)定堿性酒石酸銅溶液時(shí)所消耗的還原糖標(biāo)準(zhǔn)溶液的體積相近,約10mL左右,結(jié)果按式(1)計(jì)算;當(dāng)濃度過低時(shí)則采取直接加入10mL 樣品液,免去加水10mL,再用還原糖標(biāo)準(zhǔn)溶液滴定至終點(diǎn),記錄消耗的體積與標(biāo)定時(shí)消耗的還原糖標(biāo)準(zhǔn)溶液體積之差相當(dāng)于10mL 樣液中所含還原糖的量,結(jié)果按式(2)計(jì)算。
5.4 試樣溶液測定
吸取堿性酒石酸銅甲液5.0mL和堿性酒石酸銅乙液5.0mL,置于150mL錐形瓶中,加水10mL,加
入玻璃珠2粒~4粒,從滴定管滴加比預(yù)測體積少1mL的試樣溶液至錐形瓶中,控制在2min內(nèi)加熱至沸,保持沸騰繼續(xù)以1滴/2s的速度滴定,直至藍(lán)色剛好褪去為終點(diǎn),記錄樣液消耗體積,同法平行操作三份,得出平均消耗體積(V)。
6 分析結(jié)果的表述
試樣中還原糖的含量(以某種還原糖計(jì))按式(1)計(jì)算:
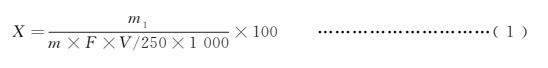
式中:
X ———試樣中還原糖的含量(以某種還原糖計(jì)),單位為克每百克(g/100g);
m1 ———堿性酒石酸銅溶液(甲、乙液各半)相當(dāng)于某種還原糖的質(zhì)量,單位為毫克(mg);
m ———試樣質(zhì)量,單位為克(g);
F ———系數(shù),對(duì)5.1.1、5.1.3、5.1.4為1;5.1.2為0.80;
V ———測定時(shí)平均消耗試樣溶液體積,單位為毫升(mL);
250 ———定容體積,單位毫升(mL);
1000———換算系數(shù)。
當(dāng)濃度過低時(shí),試樣中還原糖的含量(以某種還原糖計(jì))按式(2)計(jì)算:
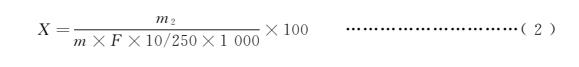
式中:
X ———試樣中還原糖的含量(以某種還原糖計(jì)),單位為克每百克(g/100g);
m2 ———標(biāo)定時(shí)體積與加入樣品后消耗的還原糖標(biāo)準(zhǔn)溶液體積之差相當(dāng)于某種還原糖的質(zhì)量,單位為毫克(mg);
m ———試樣質(zhì)量,單位為克(g);
F ———系數(shù),對(duì)5.1.1、5.1.3、5.1.4為1;5.1.2為0.80;
10 ———樣液體積,單位毫升(mL);
250 ———定容體積,單位毫升(mL );
1000———換算系數(shù)。
還原糖含量≥10g/100g時(shí),計(jì)算結(jié)果保留三位有效數(shù)字;還原糖含量<10g/100g 時(shí),計(jì)算結(jié)果保留兩位有效數(shù)字。
7 精密度
在重復(fù)性條件下獲得的兩次獨(dú)立測定結(jié)果的絕對(duì)差值不得超過算術(shù)平均值的5%。
8 其他
當(dāng)稱樣量為5g時(shí),定量限為0.25g/100g。
【注意事項(xiàng)】
1.費(fèi)林試劑甲液和乙液應(yīng)分別儲(chǔ)存,用時(shí)才混合,否則酒石酸鉀鈉銅絡(luò)合物長期在堿性條件下會(huì)慢慢分解析出氧化亞銅沉淀,使試劑有效濃度降低。
2. 滴定必須是在沸騰條件下進(jìn)行,其原因一是加快還原糖與Cu2+的反應(yīng)速度;二是亞甲基藍(lán)的變色反應(yīng)是可逆的,還原型的亞甲基藍(lán)會(huì)被空氣中的氧氧化為氧化型。此外,氧化亞銅也極不穩(wěn)定,易被空氣中的氧所氧化。保持反應(yīng)液沸騰可防止空氣進(jìn)入,避免亞甲基藍(lán)和氧化亞銅被氧化而增加消耗量。
3. 滴定時(shí)不能隨意搖動(dòng)錐形瓶,更不能把錐形瓶從熱源上取下來滴定,以防止空氣進(jìn)入反應(yīng)溶液中。
以上實(shí)驗(yàn)方法僅供參考,具體可參考此國標(biāo)標(biāo)準(zhǔn)要求操作或根據(jù)自身行業(yè)標(biāo)注要求操作。
搜索質(zhì)檢報(bào)告(COA)
搜索MSDS

斐林試劑(Fehling's solution)




